Lập hồ sơ trao đổi chất bằng LC-Q-Orbitrap HRMS
Nhìn chung, các nghiên cứu về chuyển hóa Salvia các loài ở chế độ ion hóa âm có xu hướng hiệu quả hơn các loài ở chế độ tích cực15. Trong nghiên cứu này, phân tích dữ liệu MS bao gồm việc sử dụng cơ sở dữ liệu trực tuyến và cục bộ do phần mềm Composite Discoverer 2.1 cung cấp. Ngoài ra, dữ liệu được thu thập từ các nghiên cứu chuyển hóa trước đây về Salvia các loài đã được thu thập và hợp nhất thành một danh sách lớn để triển khai như một cơ sở dữ liệu địa phương. Tổng cộng có 2704 đỉnh chất đã được phát hiện trong S. fruticosa chiết xuất trong phân tích chế độ ion âm. Sau khi lọc các tín hiệu phụ (Diện tích < 104), có 98 chất chuyển hóa trong đó 95 chất được xác định tạm thời như trong Bảng bổ sung S1.
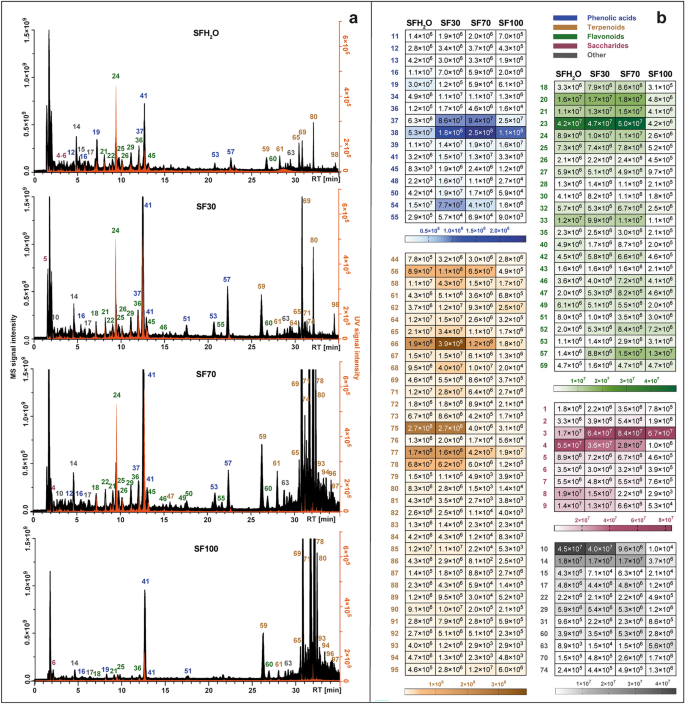
Cấu hình trao đổi chất của mỗi chiết xuất được đặt cạnh nhau và trình bày trong Hình 2. 1Một. Các nhóm thống trị đã thay đổi giữa các chiết xuất khác nhau. Ở những sản phẩm thu được bằng dung môi chứa chủ yếu là nước (SFH2O và SF30), hợp chất có nhiều nhất là axit phenolic. Hiệu suất chiết của các hợp chất terpenoid phù hợp với sự gia tăng ethanol trong dung môi đã sử dụng do tính chất không phân cực của các hợp chất này. Ngoài ra, một bản đồ nhiệt với cường độ tín hiệu của từng chất hóa học thực vật được phát hiện ở bốn loại khác nhau S. fruticosa chiết xuất được trình bày trong hình. 1b. Nhóm hợp chất nhiều nhất được phát hiện trong các chất chiết xuất được nghiên cứu là terpenoid với 35 hợp chất, tiếp theo là flavonoid (24 hợp chất), axit phenolic và các dẫn xuất (19 hợp chất), sacarit (9 hợp chất) và các loại khác như axit béo, axit cacboxylic và các hợp chất không xác định .
Sắc ký đồ ion tổng số thu được bằng LC-Q-Orbitrap ở chế độ âm tính (màu đen) kết hợp với sắc ký đồ được ghi lại bằng detector UV–Vis ở bước sóng 270 nm (màu cam) (Một), được thiết lập với bản đồ nhiệt biểu thị giá trị diện tích đỉnh MS trung bình của các hợp chất được xác định theo bốn loại khác nhau S. fruticosa chiết xuất: SFH2Chiết xuất nước O; Chiết xuất etanol SF30–30%; Chiết xuất etanol SF70–70%; Chiết xuất etanol SF100 (b). Để biết danh tính của các đỉnh, xem Bảng bổ sung S1.
Trong trường hợp hai chất chiết có cực nhất (SFH2O và SF30), axit phenolic là loại có nhiều nhất trong tổng diện tích pic. Lớp này được đại diện chủ yếu bởi các dẫn xuất axit caffeic. Thời gian lưu (RT) của hợp chất 16 với ion tiền chất [MH]¯ tại m/z 179.03419 phù hợp với RT của tiêu chuẩn axit caffeic. Nó cũng tạo ra đoạn chính đặc trưng ở m/z 135.04414, do mất đi khí cacbonic. Dạng axit caffeic bị khử proton được phát hiện trong các hợp chất 40 Và 41, được xác định là axit sagerinic ([MH]¯ tại m/z 719.16210) và axit rosmarinic ([MH]¯ ở m/z 359.0773). Việc xác định axit Rosmarinic được xác nhận bổ sung bằng cách so sánh với tiêu chuẩn. Ion tương tự hoặc sự mất mát của nó đã được quan sát thấy đối với các hợp chất 20, 37, 39, 44, 53, 57 Và 58, được hỗ trợ bằng cách so sánh với tài liệu và MS2 phân mảnh, được xác định là salviaflaside ([MH]¯ m/z 521.13012), axit salvianolic B ([MH]¯ ở m/z 717.14661), axit isosalvianolic B ([MH]¯ ở m/z 717.14667), axit salvianolic K ([MH]¯ tại m/z 555.11469), hai đồng phân F của axit salvianolic ([MH]¯ tại m/z 313.07205) và axit salvianolic C ([MH]¯ ở m/z 491.09863).
Trong trường hợp của hai dịch chiết không phân cực nhất (SF70, SF100), sự đóng góp của terpenoid là cao nhất, trong khi ở các dịch chiết còn lại, loại này chiếm khoảng một phần tư tổng diện tích pic của các hợp chất được xác định. Lớp này được đại diện chủ yếu bởi diterpenoid, là loại hợp chất không phân cực đa dạng nhất được xác định trong các chất chiết xuất được nghiên cứu. Chúng chủ yếu là diterpenoid loại abietane, mà sự phân mảnh thông qua quá trình ion hóa âm thường bao gồm cả việc loại bỏ CO2 (-44 Da), CO (-28 Da), H2O (-18 Da), ·CH3 (15 Đà). Các hợp chất 59 ([MH]¯ lúc m/z 345.17075) và 64 ([MH]¯ lúc m/z 345.17100) đều có các ion do mất phân tử carbon dioxide (m/z 301.18097) và phân tử nước (m/z 283.17038 và m/z 283.17041), và được xác định là rosmanol và epiisorosmanol. hợp chất 69 ([MH]¯ lúc m/z 329.17580) được xác định là Carnosol dựa trên kiểu phân mảnh điển hình của nó, bắt đầu bằng việc mất đi carbon dioxide (m/z 285.16604)12,15 và tiếp theo là loại bỏ gốc methyl (m/z 270.16211). Kiểu phân mảnh tương tự xảy ra trong hợp chất 80, được xác định là axit carnosic 12-metoxy ([MH]¯ tại m/z 345.20721) với các đoạn 301.21689 và 286.19385. hợp chất 78, với một ion giả phân tử tại m/z 331.19153 [MH]¯ được xác định là axit carnosic do sự có mặt của các mảnh tương ứng với sự mất đi carbon dioxide và sau đó là sự mất đi gốc isopropyl (m/z 287.20175 và 244.14687). hợp chất 70 thể hiện ion tiền chất tại [MH]¯ tại m/z 343.15524, tạo ra các mảnh đặc trưng m/z 315.16028 và m/z 299.160504 thông qua việc mất ethylene và carbon dioxide tương ứng. Điều đó cho phép chúng ta xác định được hợp chất 70 như rosmadial. Hai triterpenoid pentacycle cũng được phát hiện trong dịch chiết được thử nghiệm: hợp chất 96 Và 97, được xác định lần lượt là axit betulinic và axit ursolic, với các ion quasimolecular ở ([MH]¯ ở m/z 455.35340). Sự hiện diện của các triterpenoid này cũng được báo cáo trong S. fruticosa bởi Jash và cộng sự.16.
Trong các chất chiết xuất được nghiên cứu, đặc biệt là những chất có hàm lượng nước cao (SFH2O, SF30), một phần đáng kể của oligosaccharide và axit đường trong tổng diện tích pic của các hợp chất được xác định cũng được ghi nhận. Các hợp chất 1, 2 Và 3 được xác định tạm thời là stachyose, raffinose và sucrose, vì chúng thường là các loại đường vận chuyển chính trong Salvia giống loài31. Các hợp chất 4–8 được phân loại là axit đường. Mô hình phân mảnh của hợp chất 6 ([MH]¯ lúc m/z 135.02875) giống hệt với tôi-axit threonic. hợp chất 8 ([MH]¯ lúc m/z 149.0081) tạo ra các mảnh m/z 72.99171, 59.01249 và 87.00734 có thể được quan sát ở chế độ ion hóa âm đối với tôi-(+)-axit tartric.
Một loại hóa chất thực vật chính khác được phát hiện trong S. fruticosa chiết xuất là flavonoid. Hầu hết các hợp chất được xác định thuộc lớp này đều được gán cho flavon. hợp chất 24 được xác định rõ ràng là scutellarin bằng cách so sánh thời gian lưu, phổ UV và kiểu phân mảnh MS/MS với các mẫu của tiêu chuẩn thương mại. Các hợp chất 46 Và 55 cho thấy các ion tiền chất gần như giống nhau [MH]¯ tại m/z 299.0563 và 299.0562. hợp chất 46 tạo ra nhiều mảnh nhất ở m/z 284.03253 và 136.98682, hợp chất tương tự 55. Những dữ liệu này tương ứng với kiểu phân mảnh của herpidulin hoặc diosmetin. Vì có sự khác biệt về thời gian lưu nên cả hai hợp chất đều có thể có mặt trong S. fruticosa chiết xuất. hợp chất 49 thể hiện ion tiền chất tại [MH]¯ tại m/z 285.04065 tạo thành các ion sản phẩm cụ thể ở m/z 133.02834, 151.00261, 175.03903, phù hợp với những báo cáo về luteolin của Velamuri et al.17. hợp chất 52 ([MH]¯ lúc m/z 327.21786) được xác định là salvigenin (pectolinarigenin-7-methyl ether) vì flavone này đã được báo cáo trước đây ở S. fruticosa. hợp chất 54 thu được đỉnh bazơ [MH]¯ tại m/z 269.04578. Ion tiền chất và ion sản phẩm tại m/z 117.03332 và 151.00264 xác nhận hợp chất này là apigenin. hợp chất 56 cho tiền chất ion [MH]¯ tại m/z 329.0668, chỉ ra rằng công thức phân tử của nó là C17H14ồ7. Nó tạo ra các ion mảnh nổi bật ở m/z 299.01981 do mất hai nhóm metyl và 271.02472 do loại bỏ thêm carbon monoxide. Vì vậy, đỉnh này được xác định là jaceosidin. hợp chất 60 được xác định là cisimaritin dựa trên ion tiền chất [MH]¯ tại m/z 313.07190 và các ion sản phẩm chẩn đoán tại m/z 298.04694 và 283.02478, cho thấy sự mất đi hai gốc methyl và 255.02974 do loại bỏ carbon monoxide. hợp chất 62 ([MH]¯ lúc m/z 283.06137) tương ứng với dẫn xuất apigenin khi xem xét đoạn tại m/z 268.03772 và 117.03318. Ion mảnh đặc trưng tại m/z 240.04193 được hình thành do mất cacbon monoxit dẫn đến hợp chất 62 được xác định là genkwanin. Các kiểu phân mảnh của apigenin, herpidulin, cirsimaritin và genkwanin phù hợp với các báo cáo của Koutsoulas et al.12. hợp chất 50 là loại flavonol aglycon duy nhất được phát hiện trong các chất chiết xuất được nghiên cứu. Với tiền chất ion [MH]¯ tại m/z 315.0513 và đoạn MS/MS chính tại m/z 300.02756 do mất nhóm methyl, hợp chất này được xác định là isorhamnetin. hợp chất 30 với một ion giả phân tử [MH]¯ tại m/z 609.18329 không cho thấy bất kỳ sự phân mảnh nào, nhưng vì nó đã được báo cáo trước đó trong S. fruticosa18,19, nó được xác định tạm thời là flavanone—hesperidin. Các glycoside flavonoid tìm thấy trong nghiên cứu này chủ yếu là glucoside với đoạn đặc trưng là 162 Da, glucuronides (176 Da) và rutinoside (308 Da). Luteolin glucoside (hợp chất 22 với [MH]¯ tại m/z 447.09344) có mặt trong hầu hết các ấn phẩm liên quan đến thành phần hóa học của S. fruticosa chiết xuất12,18,19,20,21. hợp chất 26 cho thấy tiền chất ion [MH]¯ tại m/z 491.0836 và được xác định là isorhamnetin glucuronide, được báo cáo trước đó trong S. fruticosa chỉ bởi Gürbüz et al.22. hợp chất 27 ([MH]¯ lúc m/z 577.15668), được xác định là apigenin-rutinoside cũng được tìm thấy trong cây xô thơm Hy Lạp bởi Cvetkovikj et al.21.
Sự hiện diện của axit béo cũng được quan sát thấy trong S. fruticosa chiết xuất. Các hợp chất 63 Và 73 được xác định tạm thời là hai axit béo không bão hòa đa. hợp chất 63 được chỉ định là axit dihydroxyoctadecadienoic (C18H31ồ4¯). hợp chất 73 tiền chất tạo ra ion [MH]¯ tại m/z 295.22803 và các đoạn đặc trưng tại tôi/z 277.21738 ([MHH2ồ]− và 195.13837 [M-(CHO-(CH2)4-CH3)-H]¯, biểu thị vị trí của nhóm hydroxyl ở nguyên tử cacbon thứ 13. Vì vậy, nó được xác định là axit 13-hydroxy-9,11-octadecadienoic. Ngoài ra, trong S. fruticosa chiết xuất sự hiện diện của glucoside của axit tuberonic (m/z 387.16644) (hợp chất 14) là một loại hormone tăng trưởng đã được quan sát thấy.
Phân tích định lượng các hóa chất thực vật chính
Định lượng các hợp chất phenolic chính trong các dịch chiết khác nhau của S. fruticosa trọng lượng khô của nguyên liệu thực vật (mg/g DW) được trình bày trong Bảng 1. Hàm lượng axit caffeic, scutellarin, axit salvianolic B, axit rosmarinic, axit Carnosic và Carnosol được tính toán dựa trên đường chuẩn của các chất chuẩn xác thực, trong khi hàm lượng của các hợp chất khác được ước tính theo tiêu chuẩn tương tự nhất hiện có.
Nhìn chung, hợp chất có nhiều nhất trong chiết xuất cây xô thơm là axit rosmarinic, là một axit phenolic và một chất dimer của axit caffeic. Nồng độ axit rosmarinic cao nhất trong số tất cả các mẫu được thử nghiệm được tìm thấy ở SF70 (31,56 ± 1,88 mg/g DW), giống như nồng độ axit rosmarinic trong S. fruticosa được thu thập từ Croatia (29,10 ± 0,21 mg/g DW), được báo cáo bởi Mervić et al.23. Hàm lượng thậm chí còn cao hơn (60,73 mg/g DW) đã được báo cáo trong chiết xuất metanol từ giống cây xô thơm Hy Lạp được nghiên cứu bởi Sarrou et al.19Tuy nhiên, trong nghiên cứu này việc sử dụng rượu nguyên chất làm dung môi không mang lại hiệu suất thu được axit rosmarinic cao nhất. Nồng độ axit Rosmarinic trong dịch truyền (SFH2O) thấp hơn nhiều (4,96 ± 0,65 mg/g DW) so với các chiết xuất khác, điều này không phù hợp với kết quả của một so sánh tương tự được thực hiện đối với giống Thổ Nhĩ Kỳ. S. fruticosa bởi Tekin18. Axit caffeic cũng được phát hiện trong tất cả các chất chiết xuất được nghiên cứu ở nồng độ tương tự (0,13–0,15 mg/g DW), thấp hơn mười lần so với báo cáo của Mervić et al.23. Tuy nhiên, một số axit salvianolic, thuộc nhóm chất cắt chính có nguồn gốc từ axit caffeic trong cây xô thơm, lại có mặt với số lượng lớn hơn. Nồng độ axit salvianolic B cao nhất thu được trong dịch chiết SF70 và SF30 (6,86 ± 0,93 mg/g DW và 6,52 ± 0,48 mg/g DW). Axit Salvianolic K có nhiều nhất trong chiết xuất ST30 với nồng độ 6,25 ± 1,0 mg/g DW. Theo dữ liệu được trình bày bởi Cvetkovikj et al.21, nồng độ tối đa của axit salvianolic K trong số một số quần thể Hy Lạp được nghiên cứu S. fruticosa là 7,20 mg/g DW.
Các hợp chất terpenoid có nhiều nhất trong S. fruticosa là axit carnosic và carnosol, cả hai đều thuộc họ abietane diterpenoid12. Hàm lượng axit carnosic cao nhất được quan sát thấy ở SF100 (14,82 ± 1,66 mg/g DW), tiếp theo là SF70 (13,88 ± 2,52 mg/g DW) không khác biệt về mặt thống kê. Những kết quả này phù hợp với hàm lượng đo được trong dịch chiết metanol của Kallimanis et al.24 là 12,5 ± 1,6 mg/g DW. Lượng carnosol trong chiết xuất SF70 là 7,88 ± 1,33 mg/g DW và nó phù hợp với báo cáo của Sarrou et al.19. Salviol, terpenoid phổ biến thứ ba trong các chất chiết xuất được nghiên cứu, là một meroterpenoid có nguồn gốc từ abietane diterpenoid—ferruginol và phổ biến ở các loài cây xô thơm khác của Hy Lạp, ví dụ: S. pomifera25. Hợp chất này vẫn chưa được báo cáo ở S. fruticosa; tuy nhiên nó có mặt trong hầu hết các dịch chiết được nghiên cứu với hàm lượng cao nhất: 7,37 ± 0,71 mg/g DW trong SF70.
Nhóm hoạt chất sinh học thứ ba được phát hiện trong S. fruticosa chiết xuất là flavonoid. Scutellarin là một trong những flavonoid phổ biến được tìm thấy trong cây xô thơm26. Đây là flavonoid có nhiều nhất trong các chất chiết xuất được nghiên cứu với hiệu suất tương tự: 7,77 ± 0,48 mg/g DW, 8,92 ± 1,56 mg/g DW và 7,35 ± 0,9 mg/g DW trong SFH2Chiết xuất O, SF30 và SF70 tương ứng. Nồng độ của luteolin rutinoside và luteolin glucoside tương tự nhau trong tất cả các chất chiết xuất được nghiên cứu và dao động từ 1,03 đến 1,98 mg/g DW, không phù hợp với dữ liệu được báo cáo bởi Tekin et al.18, trong đó nồng độ của các hợp chất này trong dịch truyền cây xô thơm cao gấp hai đến ba lần so với chiết xuất ethanol.
Axit phenolic, flavonoid và terpenoid là những hợp chất có hoạt tính sinh học điển hình trong S. fruticosa. Như thể hiện trong bảng 1, hiệu suất chiết bị ảnh hưởng nhiều bởi hàm lượng ethanol trong dung môi. Việc chiết xuất bằng ethanol 70% mang lại tổng hiệu suất hoạt tính sinh học cao nhất, trái ngược với việc chiết xuất chỉ bằng nước. Sự khác biệt có thể thấy rõ ở hiệu suất thu được axit phenolic và terpenoid, tương ứng ở SF70 cao hơn ba lần và cao hơn bảy lần. Hiệu suất chiết xuất tối đa của flavonoid thu được bằng etanol 30% nhưng chỉ cao hơn một chút so với etanol 70%. Xem xét tất cả các nhóm hoạt chất sinh học được nghiên cứu, etanol 70% được kết luận là dung môi tốt nhất trong số các dung môi được thử nghiệm để chiết các hợp chất có hoạt tính sinh học từ S. fruticosa.
Hoạt tính chống oxy hóa
Sự hiện diện của các hợp chất thể hiện hoạt động chống oxy hóa trong nguyên liệu thực vật đã trở thành một khía cạnh quan trọng xác định các đặc tính tăng cường sức khỏe của nó. Trong trường hợp của nhiều loài cây xô thơm khác nhau, hoạt tính chống oxy hóa cao của chúng chủ yếu là do các hợp chất phenolic gây ra. Trong các nghiên cứu được trình bày, tổng hoạt tính chống oxy hóa được xác định cho S. fruticosa dịch chiết được điều chế bằng các chất chiết có độ phân cực khác nhau. Ngoài ra, hoạt tính chống oxy hóa đã được xác định đối với các hợp chất phenolic chọn lọc điển hình cho cây xô thơm và thuộc nhiều loại chất chuyển hóa thứ cấp khác nhau như axit phenolic, flavon và diterpenoid.
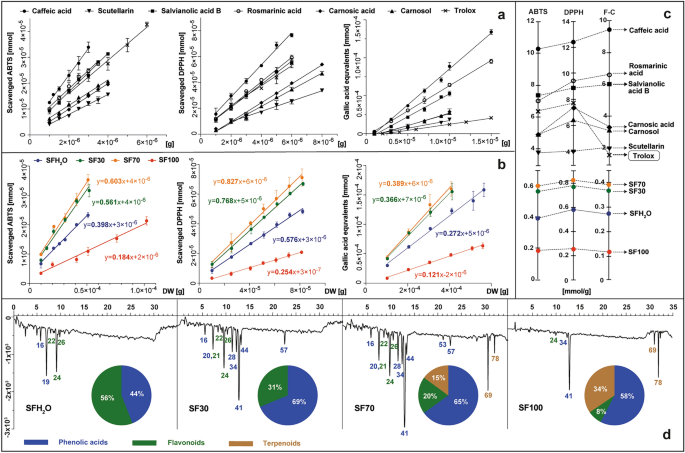
Nghiên cứu được trình bày đã so sánh kết quả của ba xét nghiệm đo quang phổ phổ biến nhất sử dụng thuốc thử ABTS, DPPH và Folin–Ciocalteu (F–C). Xét nghiệm ABTS và DPPH được sử dụng rộng rãi để xác định hoạt tính loại bỏ gốc tự do của các chất chiết xuất, cũng như các hợp chất tinh khiết. Vì S. fruticosa chiết xuất, hoạt tính chống oxy hóa được tính toán mô tả số lượng phân tử ABTS hoặc DPPH bị khử bởi các chất chống oxy hóa có nguồn gốc từ 1 g nguyên liệu khô sau 10 phút phản ứng. Các giá trị này được tính toán trong phạm vi tuyến tính của phương pháp và được biểu thị bằng độ dốc của đường mô tả mối quan hệ giữa số milimol chất oxy hóa bị khử và lượng mẫu thử khác nhau – tính bằng gam chất khô trong hỗn hợp phản ứng (Hình 2). 2b).
Hoạt tính chống oxy hóa theo tiêu chuẩn (axit caffeic, scutellarin, axit salvianolic B, axit rosmarinic, axit Carnosic, Carnosol và trolox) và S. fruticosa chiết xuất: SFH2Chiết xuất nước O; Chiết xuất etanol SF30–30%; Chiết xuất etanol SF70–70%; Chiết xuất etanol SF100, được thử nghiệm in vitro với thuốc thử ABTS, DPPH và F–C được trình bày dưới dạng đồ thị thể hiện đường cong phụ thuộc của thuốc thử bị giảm theo các tiêu chuẩn được thử nghiệm (Một) hoặc chiết xuất (b) và được biểu thị bằng độ dốc của đường cong bằng milimol thuốc thử giảm đi 1 g mẫu thử (c) được thiết lập với đặc tính chống oxy hóa của các chất chiết xuất, được đăng ký ở bước sóng 734 nm sau khi tạo dẫn xuất sau cột bằng ABTS, với các loại chất chống oxy hóa chính trên biểu đồ hình tròn (d). Để biết danh tính của các đỉnh, xem Bảng bổ sung S1.
Nghiên cứu cũng bao gồm phương pháp sử dụng thuốc thử Folin–Ciocalteu. Nó bao gồm sự chuyển electron trong môi trường kiềm từ các hợp chất có nhóm hydroxyl hoạt động sang phức hợp axit phosphotungstic phosphomolybdic. Khả năng khử trong trường hợp này được biểu thị bằng số milimol đương lượng axit gallic, tạo thành phức hợp màu xanh lam và được lấy từ 1 g chất khô của thực vật. Cách tiếp cận tương tự được sử dụng cho các chất tinh khiết được chọn có trong cây xô thơm, chẳng hạn như: axit caffeic, axit Carnosic, Carnosol, axit salvianolic B, scutellarin, axit rosmarinic và bổ sung cho chất chống oxy hóa tham chiếu—trolox (Hình 2). 2Một). Phương pháp xác định và tính toán hoạt tính chống oxy hóa của nguyên liệu thực vật và các chất nguyên chất đã được mô tả trước đây bởi Kusznierewicz et al.27 và Baranowska và cộng sự.28, tương ứng. Các giá trị độ dốc thu được được vẽ trên các trục riêng biệt cho từng thử nghiệm được tiến hành đối với các tiêu chuẩn và mẫu (Hình 2). 2c). Mỗi chất chuẩn phenolic được thử nghiệm đều thể hiện hoạt tính chống oxy hóa, theo thứ tự tăng dần như sau: scutellarin < Carnosol < axit carnosic < axit salvianolic B < axit rosmarinic < axit caffeic. Ba trong số đó – axit salvianolic B, axit rosmarinic và axit caffeic – hiệu quả hơn trolox, một hợp chất được sử dụng phổ biến làm tài liệu tham khảo trong các thử nghiệm xác định hoạt tính chống oxy hóa. Hoạt tính chống oxy hóa của tất cả các chất chiết xuất được nghiên cứu của S. fruticosa phụ thuộc vào liều lượng trong xét nghiệm ABTS cũng như trong xét nghiệm DPPH. Do đó, khi lượng chất chiết được thêm vào hỗn hợp phản ứng tăng lên thì khả năng khử đối với các gốc này cũng tăng theo. Hoạt tính chống oxy hóa tổng thể thấp nhất được quan sát thấy ở chiết xuất SF100, tiếp theo là SFH cao hơn gần hai lần.2O, và cao hơn gần bốn lần đối với SF30 và SF70. Kết quả của thử nghiệm F–C theo xu hướng tương tự như ABTS và DPPH với hệ số tương quan Pearson là 0,99, cho thấy hoạt tính chống oxy hóa của dịch chiết phụ thuộc rất lớn vào hàm lượng phenolics, như được chứng minh bởi Lantzouraki et al.29.
Dựa trên hàm lượng của 6 loại hóa chất thực vật được chọn để thử nghiệm trong dịch chiết (Bảng 1) và hoạt tính chống oxy hóa được xác định cho chúng và cho các chất chiết xuất (Hình 2). 2a,c), chúng ta có thể xác định sự đóng góp ước tính của các hợp chất này vào tổng hoạt tính chống oxy hóa của từng chất chiết xuất. Trong trường hợp SFH2Chiết xuất O, SF30 và SF70, 6 hợp chất được chọn, tùy thuộc vào thử nghiệm, về mặt lý thuyết bao phủ lần lượt 21–30%, 45–63% và 64–86% của tổng hoạt tính chống oxy hóa đã xác định. Những kết quả này cho thấy có thể có sự hiện diện của các chất chống oxy hóa bổ sung khác trong các chất chiết xuất này và/hoặc tác dụng hiệp đồng của chúng. Chỉ trong trường hợp chiết xuất SF100 thì tổng hoạt độ của 6 hợp chất tiêu chuẩn mới vượt quá tổng hoạt độ xác định của chiết xuất này trong khoảng từ 20 đến 49%, tùy thuộc vào thử nghiệm được sử dụng. Một quan sát như vậy có thể là kết quả của sự tương tác đối kháng có thể có giữa các chất phytochemical có trong loại chiết xuất này.
Thông tin chi tiết hơn về các loại chất chống oxy hóa có trong thử nghiệm S. fruticosa dịch chiết được cung cấp bằng cách sử dụng dẫn xuất sau cột HPLC với thuốc thử ABTS. Cấu hình chống oxy hóa thu được bằng phương pháp này, cũng như sự đóng góp của các loại chất chống oxy hóa khác nhau trong tổng hoạt tính chống oxy hóa, được thể hiện trong Hình 2. 2d. Ngoài 6 chất chống oxy hóa tiêu chuẩn được thử nghiệm trước đó, S. fruticosa chiết xuất cũng chứa các chất chống oxy hóa khác như axit przewalskinic A, salviaflaside, luteolin rutinoside, luteolin glucoside, isorhamnetin glucuronide, coumaroyl caffeoylglycoside, axit salvianolic K và axit salvianolic F. Cấu hình được đặc trưng bởi số lượng và kích thước lớn nhất của các đỉnh âm cho thấy sự giảm và sự đổi màu của Các gốc ABTS đã được quan sát thấy trong chiết xuất SF70 và SF30. Mặc dù có sự giống nhau về đặc tính chống oxy hóa của hai mẫu này nhưng cường độ tín hiệu chung cao hơn đối với SF70 và hoạt động bổ sung có nguồn gốc từ diterpenoid cũng được chú ý. Chỉ trong các cấu hình của chiết xuất SF70 và SF100 mới quan sát thấy các đỉnh âm có nguồn gốc từ diterpenoid, với tỷ trọng của chúng trong tổng hoạt tính kháng gốc lần lượt là 15 và 34%. Chất chống oxy hóa chính trong tất cả các chất chiết xuất có chứa ethanol là axit rosmarinic – axit phenolic dồi dào nhất và là một trong những chất chống oxy hóa mạnh nhất trong số các tiêu chuẩn được nghiên cứu. Kết quả tương tự cũng được báo cáo cho S. chính thức Và S. gốc Tây Ban Nha chiết xuất30,31.
Trong dịch chiết nước (SFH2O) hoạt tính chống oxy hóa bắt nguồn chủ yếu từ hai hợp chất: axit przewalskinic A và scutellarin, vì việc chiết xuất axit rosmarinic chỉ bằng nước sẽ kém hiệu quả hơn.
Hoạt tính ức chế xanthine oxyase
Enzym xanthine oxidase (XO) xúc tác quá trình oxy hóa hypoxanthine và xanthine thành axit uric, chất này dư thừa trong máu sẽ khiến bệnh gút phát triển. Trong quá trình tái oxy hóa XO, oxy phân tử đóng vai trò là chất nhận điện tử, tạo ra gốc superoxide và hydro peroxide. Do đó, XO được coi là nguồn sinh học quan trọng của các gốc superoxide, cùng với các loại oxy phản ứng khác, góp phần gây ra stress oxy hóa của cơ thể và tham gia vào nhiều quá trình bệnh lý như viêm, xơ vữa động mạch, ung thư, lão hóa, v.v.32. Một phương pháp điều trị gần đây để điều trị tăng axit uric máu là ức chế enzyme XO. Nhiều loại thuốc có chứa chất ức chế XO (allopurinol, febuxostat) đã được phát triển nhưng việc sử dụng chúng không may có liên quan đến một số tác dụng phụ. Vì lý do này, người ta không ngừng tìm kiếm các chất ức chế XO tự nhiên có thể cung cấp giải pháp thay thế cho các hợp chất tổng hợp này. Có một số báo cáo trong tài liệu về khả năng của một số loài Salvia (S. plebeia, S. miltiorrhiza, S. cỏ roi ngựa) để ức chế XO33,34,35, do đó, khả năng xảy ra hoạt động này cũng đã được thử nghiệm trong nghiên cứu S. fruticosa chiết xuất. Ngoài ra, hoạt tính ức chế XO cũng được xác định ở các hợp chất phenolic chọn lọc đặc trưng cho cây xô thơm như: axit caffeic, axit carnosic, carnosol, axit salvianolic B, scutellarin, axit rosmarinic và bổ sung thêm chất ức chế XO allopurinol để tham khảo.
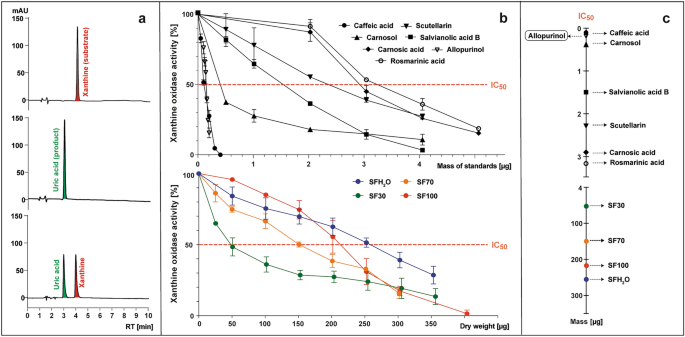
Sự biến đổi xanthine (cơ chất) thành axit uric (sản phẩm) bằng XO có hoặc không có sự hiện diện của các mẫu thử nghiệm được theo dõi bằng cách sử dụng HPLC-PAD ở bước sóng 285 nm (Hình 2). 3Một). Hoạt tính của enzyme được tính bằng phần trăm diện tích pic axit uric được hình thành khi có mặt mẫu thử so với mẫu đối chứng khi không thêm mẫu (Hình 2). 3b). Sự ức chế enzyme XO được biểu thị bằng IC50 giá trị, nghĩa là khối lượng chuẩn hoặc trọng lượng khô của mẫu (μg) có khả năng làm giảm hoạt tính của enzyme xuống 50% (Hình 2). 3b, c).
Các ví dụ về sắc ký đồ HPLC ở bước sóng 285 nm của hỗn hợp sau phản ứng có chứa (từ trên xuống): xanthine; xanthine và xanthine oxyase (XO); xanthine, XO và chất ức chế (Một), làm cơ sở cho việc chuẩn bị đồ thị biểu diễn đường cong hoạt tính XO với sự có mặt của các chất chuẩn được thử nghiệm (axit caffeic, scutellarin, axit salvianolic B, axit rosmarinic, axit Carnosic, Carnosol và allopurinol) hoặc S. fruticosa chiết xuất (SFH2Chiết xuất nước O; Chiết xuất etanol SF30–30%; Chiết xuất etanol SF70–70%; SF100 – chiết xuất ethanol) (b), được sử dụng để xác định tham số IC50, nghĩa là số microgam của mẫu thử nghiệm cần thiết để giảm hoạt tính XO xuống 50% (c).
Chất ức chế XO đã biết allopurinol được sử dụng làm đối chứng, với IC50 giá trị 0,15 μg (5,5 μM). Tất cả các chất chuẩn nghiên cứu đều cho thấy hoạt tính ức chế XO bằng IC50 dao động từ 0,1 đến 3,15 μg (2,8–43,8 µM). Hoạt tính ức chế XO tăng dần theo thứ tự như sau: axit rosmarinic < axit carnosic < scutellarin < axit salvianolic B < carnosol < axit caffeic. Axit caffeic có IC thấp nhất50 giá trị (0,1 μg; 2,8 µM), cho thấy hoạt tính ức chế XO mạnh nhất trong số các hợp chất được thử nghiệm. Nó thậm chí còn mạnh hơn allopurinol, điều này không phù hợp với dữ liệu do Wan và cộng sự trình bày.36 và Flemmig và cộng sự.37, nơi IC50 của axit caffeic thấp hơn gần 8 hoặc 2 lần so với allopurinol. Những khác biệt này có thể xuất phát từ nguồn gốc của XO được chọn cho các thử nghiệm. Trong các nghiên cứu được trích dẫn, oxidase từ sữa bò đã được sử dụng, trong khi đối với nghiên cứu này, oxidase vi sinh vật đã được chọn. Trong nghiên cứu này, axit rosmarinic có khả năng ức chế XO thấp nhất (3,2 μg; 43,8 µM), nhưng Ghallab et al.38 báo cáo rằng sự kết hợp hiệp đồng của allopurinol và axit rosmarinic có thể làm giảm liều lượng thuốc tổng hợp cần thiết. XO bị ức chế bởi tất cả các nghiên cứu S. fruticosa chiết xuất, mặc dù kém hiệu quả hơn 1000 lần so với allopurinol, phù hợp với dữ liệu được báo cáo cho các sản phẩm khác Salvia giống loài. Scutellarin và các flavon khác trước đây được mô tả là chất ức chế mạnh XO39. Mặc dù chỉ có sự khác biệt nhỏ về hàm lượng flavonoid tổng số giữa chiết xuất SF30 và SF70 và hàm lượng các hợp chất chống viêm khác có lợi hơn cho chiết xuất SF70 nhưng SF30 có khả năng ức chế hoạt động XO mạnh nhất. IC50 giá trị của SF30 là 50 μg và dựa trên thông số này, hoạt tính kháng viêm tiềm tàng của SF70, SF100 và SFH2Chiết xuất O được xác định lần lượt yếu hơn 3, 4 và 5 lần.