使用 LC-Q-Orbitrap HRMS 进行代谢组学分析
一般来说,代谢组学研究 丹参 负电离模式下的物质往往比正电离模式下的物质更有效15。在本研究中,MS 数据分析包括使用由Compound Discoverer 2.1 软件提供的在线和本地数据库。此外,从之前的代谢组学研究中收集的数据 丹参 收集物种并将其合并到一个大规模清单中,以作为本地数据库实施。共检测到 2704 个物质峰 紫果海棠 负离子模式分析中的提取物。滤除微小信号后(面积 < 104),共有 98 种代谢物,其中 95 种被初步鉴定,如补充表所示 S1.
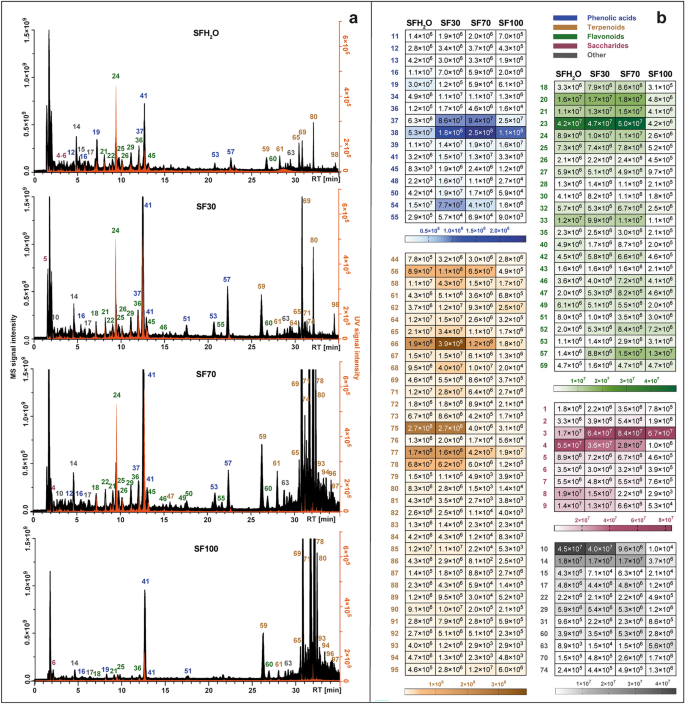
每种提取物的代谢谱并列并显示在图 1 中。 1A。不同提取物中的优势群体发生了变化。在用主要含水的溶剂获得的那些中(SFH2O和SF30)最丰富的化合物是酚酸。由于萜类化合物的非极性性质,萜类化合物的提取效率与所用溶剂中乙醇的增加一致。此外,热图显示了四种不同植物化学物质的信号强度 紫果海棠 提取物如图所示。 1b.在研究的提取物中检测到的最多一类化合物是萜类化合物,有 35 种化合物,其次是类黄酮(24 种化合物)、酚酸及其衍生物(19 种化合物)、糖类(9 种化合物)以及其他如脂肪酸、羧酸和未鉴定的化合物。
LC-Q-Orbitrap 在负模式下获得的总离子色谱图(黑色)与 UV-Vis 检测器在 270 nm 处记录的色谱图(橙色)相结合(A),设置热图,表示四种不同中已识别化合物的平均 MS 峰面积值 紫果海棠 摘录:SFH2O——水提取物; SF30–30%乙醇提取物; SF70–70%乙醇提取物; SF100–乙醇提取物(乙)。对于峰的识别,请参见补充表 S1.
对于两种极性最强的提取物(SFH2O 和 SF30) 酚酸是总峰面积中最丰富的类别。此类主要以咖啡酸衍生物为代表。化合物的保留时间 (RT) 16 前体离子 [MH] ́ 在 质量分数 179.03419符合咖啡酸标准品的保留时间。它还在以下位置生成了特征主要片段: 质量分数 135.04414,由于二氧化碳的损失。在化合物中检测到咖啡酸的去质子化形式 40 和 41,被鉴定为鼠尾草酸 ([MH] ́ at 质量分数 719.16210) 和迷迭香酸 ([MH]) 质量分数 359.0773)。通过与标准品比较进一步确认了迷迭香酸的鉴定。已观察到化合物具有相同的离子或其丢失 20, 37, 39, 44, 53, 57 和 58,通过与文献和 MS 的比较来支持2 碎片,被鉴定为丹参苷 ([MH] ́ 质量分数 521.13012), 丹酚酸 B ([MH]¯ 在 质量分数 717.14661), 异丹酚酸 B ([MH]) 质量分数 717.14667), 丹酚酸 K ([MH]¯ 在 质量分数 555.11469), 两种丹酚酸 F 异构体 ([MH] ́ at 质量分数 313.07205) 和丹酚酸 C ([MH] ́ at 质量分数 491.09863).
在两种非极性提取物(SF70、SF100)中,萜类化合物的贡献最高,而在其余提取物中,此类化合物约占已识别化合物峰面积总和的四分之一。这类化合物主要以二萜类化合物为代表,它们是研究提取物中鉴定出的种类最多的非极性化合物。它们大多是松香烷型二萜类化合物,通过负电离进行裂解通常包括去除 CO2 (-44 Da), CO (-28 Da), H2O (-18 Da), ·CH3 (15 Da)。化合物 59 ([MH] ́ 于 质量分数 345.17075)和 64 ([MH] ́ 于 质量分数 345.17100)都显示出由于二氧化碳分子损失而产生的离子(质量分数 301.18097) 和水分子 (质量分数 283.17038 和 质量分数 283.17041),并被鉴定为迷迭香酚和表异迷迭香酚。化合物 69 ([MH] ́ 于 质量分数 329.17580)根据其典型的碎片模式(从二氧化碳的损失开始)被鉴定为鼠尾草酚(质量分数 285.16604)12,15 然后消除甲基自由基(质量分数 270.16211)。化合物中也出现相同的碎片模式 80, 鉴定为 12-甲氧基鼠尾草酸 ([MH] ́ at 质量分数 345.20721)与301.21689和286.19385的片段。化合物 78,具有伪分子离子 质量分数 331.19153 [MH] 被鉴定为鼠尾草酸,因为存在对应于二氧化碳损失和随后异丙基自由基损失的片段(质量分数 287.20175 和 244.14687)。化合物 70 在 [MH] 处显示前体离子 质量分数 343.15524,生成特征片段 质量分数 315.16028 和 质量分数 299.160504 分别通过乙烯和二氧化碳的损失。这使我们能够识别化合物 70 作为罗斯马迪亚。在测试的提取物中还检测到两种五环三萜类化合物: 96 和 97,初步鉴定为桦木酸和熊果酸,分别具有准分子离子 ([MH]¯ at 质量分数 455.35340)。这些三萜类化合物的存在也有报道 紫果海棠 贾什等人。16.
在研究的提取物中,尤其是那些含水量高的提取物(SFH2O, SF30),还注意到低聚糖和糖酸在已鉴定化合物的总峰面积中占有很大份额。化合物 1, 2 和 3 初步鉴定为水苏糖、棉子糖和蔗糖,因为它们通常是体内主要的运输糖。 丹参 物种31。化合物 4–8 被归类为糖酸。化合物的碎片模式 6 ([MH] ́ 于 质量分数 135.02875) 与 我-苏糖酸。化合物 8 ([MH] ́ 于 质量分数 149.0081) 生成的片段 质量分数 72.99171、59.01249 和 87.00734 可以在负电离模式下观察到 我-(+)-酒石酸。
检测到的另一类主要植物化学物质 紫果海棠 提取物为黄酮类化合物。大多数已鉴定的属于此类的化合物都被归为黄酮。化合物 24 通过将保留时间、紫外光谱和 MS/MS 碎片模式与商业标准品进行比较,可以明确地鉴定为灯盏花乙素。化合物 46 和 55 显示出几乎相同的前体离子 [MH]¯ 质量分数 299.0563 和 299.0562。化合物 46 产生最丰富的片段 质量分数 284.03253 和 136.98682,类似的复合 55。这些数据与组毛蛋白或香叶木素的碎片模式相对应。由于保留时间存在差异,两种化合物都可能存在于 紫果海棠 提取物。化合物 49 在 [MH] 处显示前体离子 质量分数 285.04065 形成特定产物离子 质量分数 133.02834、151.00261、175.03903,与 Velamuri 等人报道的木犀草素一致。17。化合物 52 ([MH] ́ 于 质量分数 327.21786) 被鉴定为 Salvigenin (pectolinarigenin-7-methyl ether),因为这种黄酮先前已在 紫果海棠。化合物 54 产生基峰 [MH] ́ 质量分数 269.04578。母离子和子离子在 质量分数 117.03332和151.00264证实该化合物是芹菜素。化合物 56 给出前体离子 [MH] ́ 质量分数 329.0668,表明其分子式为C17H14氧7。它产生了显着的碎片离子 质量分数 299.01981归因于失去两个甲基,271.02472归因于进一步消除一氧化碳。因此,该峰被鉴定为jaceosidin。化合物 60 根据母离子 [MH] 被鉴定为 cisimaritin 质量分数 313.07190 和诊断产物离子 质量分数 298.04694和283.02478,表明由于一氧化碳的消除而损失了两个甲基自由基和255.02974。化合物 62 ([MH] ́ 于 质量分数 283.06137)对应于芹菜素衍生物,考虑到片段 质量分数 268.03772 和 117.03318。特征碎片离子 质量分数 240.04193 由一氧化碳损失导致化合物形成 62 经鉴定为genkwanin。芹菜素、Hispidulin、Cirsimaritin 和 genkwanin 的断裂模式与 Koutsoulas 等人报道的一致。12。化合物 50 是在研究提取物中检测到的唯一类型的黄酮醇苷元。母离子 [MH] 位于 质量分数 315.0513 和主要 MS/MS 片段位于 质量分数 300.02756 由于甲基基团的丢失,该化合物被鉴定为异鼠李素。化合物 30 与准分子离子 [MH] ́ 在 质量分数 609.18329 没有显示任何碎片,但由于之前曾报道过 紫果海棠18,19初步鉴定为黄烷酮-橙皮苷。本研究发现的黄酮苷主要为特征片段为162 Da的葡萄糖苷、葡萄糖醛酸苷(176 Da)和芸香苷(308 Da)。木犀草素葡萄糖苷(化合物 22 与 [MH] ́ 在 质量分数 447.09344)存在于大多数有关化学成分的出版物中 紫果海棠 提取物12,18,19,20,21。化合物 26 显示出前体离子 [MH] ́ 质量分数 491.0836 并被鉴定为异鼠李素葡萄糖醛酸苷,早先报道于 紫果海棠 仅由 Gürbüz 等人提出。22。化合物 27 ([MH] 于 质量分数 Cvetkovikj 等人也在希腊鼠尾草中发现了芹菜素-芸香苷(577.15668),被鉴定为芹菜素-芸香苷。21.
还观察到脂肪酸的存在 紫果海棠 提取物。化合物 63 和 73 初步鉴定为两种多不饱和脂肪酸。化合物 63 被指定为二羟基十八碳二烯酸(C18H31氧4)。化合物 73 产生前体离子 [MH] ́ 质量分数 295.22803 和特征片段 米/z 277.21738([MHH2欧]- 和 195.13837 [M-(CHO-(CH2)4-CH3)-H]¯,表示13个碳原子处羟基的位置。因此,它被鉴定为13-羟基-9,11-十八二烯酸。另外,在 紫果海棠 提取块茎酸葡萄糖苷的存在(质量分数 387.16644)(复合 14),这是一种生长激素,被观察到。
主要植物化学物质的定量分析
不同提取物中主要酚类化合物的定量分析 紫果海棠 植物材料的干重 (mg/g DW) 列于表中 1。根据真实标准品的校准曲线计算咖啡酸、灯盏花乙素、丹酚酸B、迷迭香酸、鼠尾草酸和鼠尾草酚的含量,而其他化合物的含量则根据最相似的可用标准品估算。
总的来说,鼠尾草提取物中最丰富的化合物是迷迭香酸,它是一种酚酸和咖啡酸的二聚体。所有测试样品中迷迭香酸的浓度最高的是 SF70(31.56 ± 1.88 mg/g DW),这与 SF70 中迷迭香酸的浓度相同。 紫果海棠 Mervić 等人报道,从克罗地亚采集(29.10 ± 0.21 mg/g DW)。23。 Sarrou 等人研究的希腊鼠尾草甲醇提取物中的含量甚至更高(60.73 mg/g DW)。19,但在本研究中使用纯酒精作为溶剂并没有获得最高的迷迭香酸产率。输液中迷迭香酸浓度(SFH2O)比其他提取物低得多(4.96 ± 0.65 mg/g DW),这与土耳其品种的类似比较结果不一致 紫果海棠 通过泰金18。在所有研究的提取物中也检测到了类似浓度(0.13-0.15 mg/g DW)的咖啡酸,比 Mervić 等人报告的浓度低十倍。23。然而,丹酚酸(属于鼠尾草植物中主要的咖啡酸衍生三聚体)的含量很少。 SF70 和 SF30 提取物中丹酚酸 B 的浓度最高(6.86 ± 0.93 mg/g DW 和 6.52 ± 0.48 mg/g DW)。 ST30 提取物中丹酚酸 K 的含量最丰富,浓度为 6.25 ± 1.0 mg/g DW。根据 Cvetkovikj 等人提供的数据。21,几个研究的希腊人群中丹酚酸 K 的最大浓度 紫果海棠 为 7.20 毫克/克干重。
中含量最丰富的萜类化合物 紫果海棠 是鼠尾草酸和鼠尾草酚,它们都属于松香烷二萜类化合物家族12。 SF100 中鼠尾草酸含量最高(14.82 ± 1.66 mg/g DW),其次是 SF70(13.88 ± 2.52 mg/g DW),两者没有统计学差异。这些结果与 Kallimanis 等人在甲醇提取物中测量的含量一致。24 其值为 12.5 ± 1.6 毫克/克干重。 SF70 提取物中鼠尾草酚的含量为 7.88 ± 1.33 mg/g DW,与 Sarrou 等人报道的一致。19。丹参酚是所研究的提取物中第三丰富的萜类化合物,是一种源自松香烷二萜类化合物铁鲁吉醇的类萜,在其他希腊鼠尾草物种中很常见,例如 波米费拉25。该化合物尚未见报道 紫果海棠;然而,它存在于大多数研究的提取物中,含量最高:SF70 中的 7.37 ± 0.71 mg/g DW。
检测到的第三组生物活性物质 紫果海棠 提取物为黄酮类化合物。灯盏乙素是鼠尾草中常见的黄酮类化合物之一26。它是所研究的提取物中最丰富的类黄酮,且产量相似:SFH 中的 7.77 ± 0.48 mg/g DW、8.92 ± 1.56 mg/g DW 和 7.35 ± 0.9 mg/g DW2分别为 O、SF30 和 SF70 提取物。所有研究提取物中木犀草素芸香苷和木犀草素葡萄糖苷的浓度相似,范围为 1.03 至 1.98 mg/g DW,这与 Tekin 等人报告的数据不一致。18,其中这些化合物在鼠尾草浸液中的浓度比乙醇提取物中的浓度高两到三倍。
酚酸、黄酮类和萜类化合物是典型的生物活性化合物。 紫果海棠。如表所示 1,提取率受溶剂中乙醇含量的影响很大。与仅用水提取相比,用 70% 乙醇提取可提供最高的生物活性物质总收率。酚酸和萜类化合物产量的差异显而易见,SF70 中的酚酸和萜类化合物产量分别高出三倍和七倍。 30%乙醇的黄酮类化合物提取率最高,但仅略高于70%乙醇。考虑到所研究的所有生物活性组,70% 乙醇被认为是用于提取生物活性化合物的测试溶剂中的最佳溶剂。 紫果海棠.
抗氧化活性
植物材料中存在的具有抗氧化活性的化合物已成为定义其促进健康特性的一个重要方面。就各种鼠尾草品种而言,它们的高抗氧化活性主要是由酚类化合物引起的。在所提出的研究中,确定了总抗氧化活性 紫果海棠 用不同极性的萃取剂制备的萃取物。此外,还测定了鼠尾草中典型的选定酚类化合物的抗氧化活性,这些酚类化合物属于各种次级代谢产物,如酚酸、黄酮和二萜类化合物。
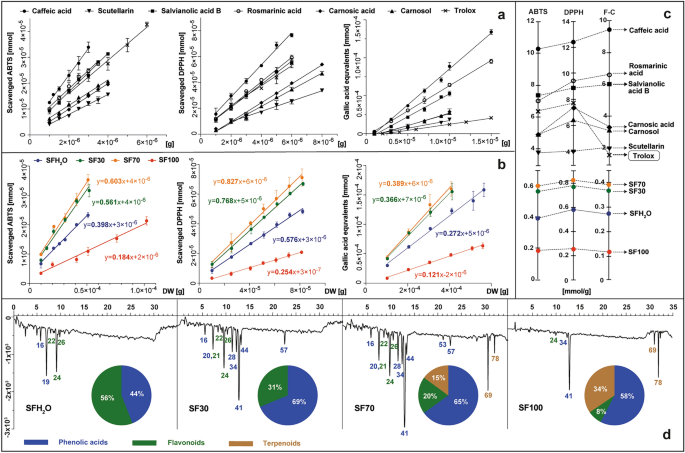
本研究比较了使用 ABTS、DPPH 和 Folin-Ciocalteu (F-C) 试剂的三种最流行的分光光度测试的结果。 ABTS 和 DPPH 测定广泛用于测定提取物的自由基清除活性,纯化合物也是如此。为了 紫果海棠 提取物中,计算的抗氧化活性描述了反应 10 分钟后 1 g 干燥材料中的抗氧化剂减少的 ABTS 或 DPPH 分子的数量。这些值是在方法的线性范围内计算的,并表示为描述还原的氧化剂毫摩尔数与不同量的测试样品之间关系的直线斜率——以反应混合物中的干物质克数表示(图1)。 2b).
标准品(咖啡酸、灯盏花乙素、丹酚酸 B、迷迭香酸、鼠尾草酸、鼠尾草酚和 trolox)和 紫果海棠 摘录:SFH2O——水提取物; SF30–30%乙醇提取物; SF70–70%乙醇提取物; SF100-乙醇提取物,使用 ABTS、DPPH 和 F-C 试剂进行体外测试,以图形式显示试剂的依赖性曲线,该曲线通过测试标准降低(A)或摘录(乙) 并表示为曲线的斜率等于 1 g 测试样品减少的试剂毫摩尔数 (C)设置了提取物的抗氧化剂特征,用 ABTS 柱后衍生化后在 734 nm 处记录,饼图上显示了主要类别的抗氧化剂(d)。对于峰的识别,请参见补充表 S1.
该研究还包括使用 Folin-Ciocalteu 试剂的方法。它包括在碱性环境中电子从具有活性羟基的化合物转移到磷钼磷钨酸络合物。这种情况下的还原能力表示为没食子酸当量的毫摩尔数,该没食子酸形成蓝色复合物并源自1克植物干物质。同样的方法也适用于鼠尾草中选定的纯物质,例如:咖啡酸、鼠尾草酸、鼠尾草酚、丹酚酸 B、灯盏花乙素、迷迭香酸以及参考抗氧化剂 - trolox(图 1)。 2A)。 Kusznierewicz 等人先前描述了这种测定和计算植物材料和纯物质的抗氧化活性的方法。27 和巴拉诺夫斯卡等人。28, 分别。对于标准品和样品进行的每次测试,将所得的斜率值绘制在单独的轴上(图 1)。 2C)。每种测试的酚类标准品均表现出抗氧化活性,按如下顺序递增:灯盏乙素 < 鼠尾草酚 < 鼠尾草酸 < 丹酚酸 B < 迷迭香酸 < 咖啡酸。其中三种——丹酚酸 B、迷迭香酸和咖啡酸——比维生素E更有效,维生素E是一种在抗氧化活性测定中常用作参考的化合物。所有研究的提取物的抗氧化活性 紫果海棠 在 ABTS 测定以及 DPPH 测试中呈剂量依赖性。因此,随着添加到反应混合物中的提取物的量增加,对这些自由基的还原能力也增加。 SF100 提取物的总抗氧化活性最低,其次是 SFH 的几乎两倍2O,SF30 和 SF70 几乎高出四倍。 F-C 测试的结果与 ABTS 和 DPPH 的趋势相同,Pearson 相关性为 0.99,这表明提取物的抗氧化活性很大程度上取决于酚类物质的含量,正如 Lantzouraki 等人所证明的那样。29.
根据提取物中选择测试的 6 种植物化学物质的含量(表 1)以及它们和提取物的抗氧化活性(图 1)。 2a,c),我们可以确定这些化合物对各个提取物的总抗氧化活性的估计贡献。就 SFH 而言2O、SF30 和 SF70 提取物,6 种选定的化合物,根据测试,理论上分别覆盖了测定的总抗氧化活性的 21-30%、45-63% 和 64-86%。这些结果表明这些提取物中可能存在其他额外的抗氧化剂和/或其协同作用。仅在 SF100 提取物的情况下,6 种标准化合物的活性总和超过了该提取物测定的总活性,范围为 20 至 49%,具体取决于所使用的测试。这种观察结果可能是这种提取物中存在的植物化学物质之间可能存在拮抗相互作用的结果。
有关测试中存在的抗氧化剂类型的更多详细信息 紫果海棠 通过使用 ABTS 试剂进行 HPLC 柱后衍生化来提供提取物。通过该方法获得的抗氧化谱,以及不同类别的抗氧化剂在总抗氧化活性中的贡献,如图1所示。 2d.除了之前测试的 6 种标准抗氧化剂外, 紫果海棠 提取物还含有其他抗氧化剂,如普氏原酸 A、丹参黄苷、木犀草素芸香苷、木犀草素葡萄糖苷、异鼠李素葡萄糖苷酸、香豆酰咖啡酰糖苷、丹酚酸 K 和丹酚酸 F。 SF70 和 SF30 提取物中观察到 ABTS 自由基。尽管这两个样品的抗氧化特性相似,但 SF70 的共同信号强度较高,并且还注意到源自二萜类化合物的额外活性。仅在 SF70 和 SF100 提取物的谱中观察到源自二萜类化合物的负峰,其在总抗自由基活性中的份额分别为 15 和 34%。所有含有乙醇的提取物中的主要抗氧化剂是迷迭香酸——最丰富的酚酸,也是研究标准中最强的抗氧化剂之一。也报告了相同的结果 药用植物 和 西班牙沙门氏菌 提取物30,31.
水提取物(SFH2O) 抗氧化活性主要来自两种化合物:普氏野酸 A 和灯盏花乙素,因为单独用水提取迷迭香酸效果较差。
黄嘌呤氧化酶抑制活性
黄嘌呤氧化酶 (XO) 催化次黄嘌呤和黄嘌呤氧化成尿酸,血液中尿酸过量会导致痛风。在 XO 再氧化过程中,分子氧充当电子受体,产生超氧自由基和过氧化氢。因此,XO被认为是超氧自由基的重要生物来源,超氧自由基与其他活性氧一起导致人体氧化应激,并参与许多病理过程,如炎症、动脉粥样硬化、癌症、衰老等。32。最近治疗高尿酸血症的方法是抑制 XO 酶。已经开发了多种含有 XO 抑制剂(别嘌呤醇、非布索坦)的药物,不幸的是,这些药物的使用会产生某些副作用。因此,人们一直在寻找可以替代这些合成化合物的天然 XO 抑制剂。文献中有一些关于几种物种能力的报道 丹参 (S. plebeia、S. miltiorriza、S. 马鞭草) 抑制 XO33,34,35因此,在研究中也测试了这种活动发生的可能 紫果海棠 提取物。此外,还测定了鼠尾草典型的选定酚类化合物的 XO 抑制活性,例如:咖啡酸、鼠尾草酸、鼠尾草酚、丹酚酸 B、灯盏花乙素、迷迭香酸以及另外作为参考的 XO 抑制剂别嘌呤醇。
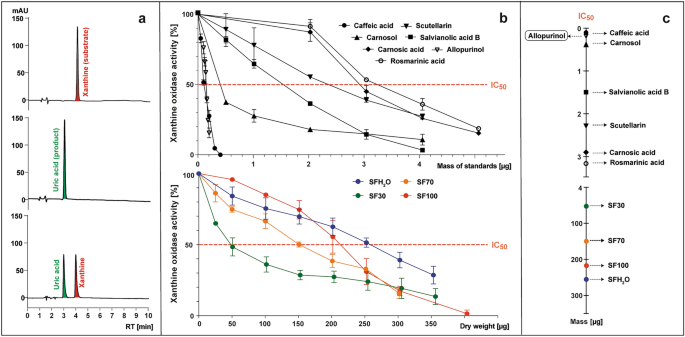
使用 HPLC-PAD 在 285 nm 处监测 XO 在存在或不存在测试样品的情况下将黄嘌呤(底物)转化为尿酸(产物)的情况(图 1)。 3A)。酶活性计算为在测试样品存在下形成的尿酸峰面积与不添加样品的对照相比的百分比(图1)。 3b). XO酶的抑制作用以IC表示50 值,是指能够将酶活性降低至50%的标准质量或样品干重(μg)(图1)。 3公元前)。
使用已知的 XO 抑制剂别嘌呤醇作为参考,IC50 值为 0.15 µg (5.5 µM)。所有研究的标准品都显示了 IC 的 XO 抑制活性50 范围为 0.1 至 3.15 µg (2.8–43.8 µM)。 XO抑制活性按如下顺序增加:迷迭香酸<鼠尾草酸<灯盏花乙素<丹酚酸B<鼠尾草酚<咖啡酸。咖啡酸的 IC 值最低50 值(0.1 μg;2.8 μM),表明测试化合物中 XO 抑制活性最强。它甚至比别嘌呤醇更强,这与 Wan 等人提供的数据不一致。36 和弗莱米格等人。37,其中IC50 咖啡酸的含量几乎分别比别嘌呤醇低 8 倍或 2 倍。这些差异可能是由测试所选择的 XO 的来源造成的。在引用的研究中,使用了来自牛奶的氧化酶,而本研究选择了微生物氧化酶。在这项研究中,迷迭香酸对 XO 的抑制作用最低(3.2 μg;43.8 µM),但 Ghallab 等人。38 据报道,别嘌呤醇和迷迭香酸的协同组合可以降低所需合成药物的剂量。 XO 被所有研究抑制 紫果海棠 尽管比别嘌呤醇的效率低 1000 多倍,但与其他报告的数据一致 丹参 物种。灯盏乙素和其他黄酮先前已被描述为 XO 的强抑制剂39。尽管SF30和SF70提取物的总黄酮含量差异不大,并且其他抗炎化合物的含量对SF70提取物更有利,但SF30对XO活性的抑制能力最强。集成电路50 SF30 的值为 50 μg,根据该参数,SF70、SF100 和 SFH 的潜在抗炎活性2O 提取物被确定为分别弱 3、4 和 5 倍。