Perfiles metabolómicos utilizando LC-Q-Orbitrap HRMS
En general, los estudios metabolómicos sobre Salvia Las especies en modo de ionización negativa tienden a ser más eficientes que aquellas en modo positivo.15. En este estudio, el análisis de datos de MS incluyó el uso de bases de datos locales y en línea proporcionadas por el software Compound Discoverer 2.1. Además, los datos recopilados de estudios metabolómicos previos sobre Salvia Las especies se recolectaron y fusionaron en una lista masiva que se implementará como una base de datos local. En total se detectaron 2.704 picos de sustancias en S. fruticosa extractos en análisis en modo de iones negativos. Después de filtrar las señales menores (Área < 104), hubo 98 metabolitos de los cuales 95 se identificaron tentativamente como se muestra en la tabla complementaria T1.
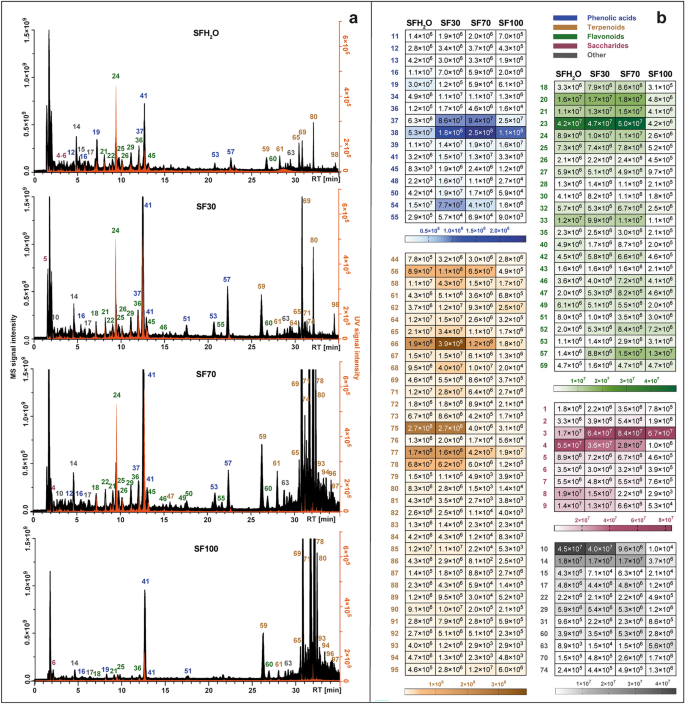
Los perfiles de metabolitos de cada extracto se yuxtapusieron y se presentaron en la Fig. 1a. Los grupos dominantes cambiaron entre diferentes extractos. En los obtenidos con disolventes que contienen mayoritariamente agua (SFH2O y SF30) los compuestos más abundantes fueron los ácidos fenólicos. La eficiencia de extracción de los compuestos terpenoides fue consistente con el aumento de etanol en el solvente usado debido a la naturaleza no polar de estos compuestos. Además, un mapa de calor con la intensidad de la señal de fitoquímicos individuales detectados en cuatro diferentes S. fruticosa extractos se presenta en la Fig. 1b. La clase de compuestos más numerosa detectada en los extractos estudiados fue la de los terpenoides con 35 compuestos, seguida de los flavonoides (24 compuestos), ácidos fenólicos y derivados (19 compuestos), sacáridos (9 compuestos) y otros como ácidos grasos, ácidos carboxílicos y compuestos no identificados. .
Cromatogramas de iones totales obtenidos por LC-Q-Orbitrap en modo negativo (negro) combinados con cromatogramas registrados por detector UV-Vis a 270 nm (naranja) (a), configurado con un mapa de calor que representa el valor medio del área del pico de MS de los compuestos identificados en cuatro diferentes S. fruticosa extractos: SFH2O-extracto acuoso; Extracto de etanol SF30–30%; extracto de etanol SF70–70%; SF100–extracto de etanol (b). Para conocer la identidad de los picos, consulte la tabla complementaria. T1.
En el caso de dos extractos más polares (SFH2O y SF30), los ácidos fenólicos fueron las clases más abundantes en el área total del pico. Esta clase estuvo representada principalmente por derivados del ácido cafeico. El tiempo de retención (RT) del compuesto. 16 con ion precursor [MH]¯ en m/z 179.03419 estaba en línea con el RT de la norma del ácido cafeico. También generó un fragmento importante característico en m/z 135.04414, por pérdida de dióxido de carbono. Se detectó la forma desprotonada del ácido cafeico en compuestos 40 y 41, que fueron identificados como ácido sagerínico ([MH]¯ en m/z 719.16210) y ácido rosmarínico ([MH]¯ en m/z 359.0773). La identificación del ácido rosmarínico se confirmó además mediante comparación con el estándar. Se había observado el mismo ion o su pérdida en compuestos 20, 37, 39, 44, 53, 57 y 58, que apoyó en comparación con la literatura y MS2 fragmentación, fueron identificados como salviaflasida ([MH]¯ m/z 521.13012), ácido salvianólico B ([MH]¯ en m/z 717.14661), ácido isosalvianólico B ([MH]¯ en m/z 717.14667), ácido salvianólico K ([MH]¯ en m/z 555.11469), dos isómeros F del ácido salvianólico ([MH]¯ en m/z 313.07205) y ácido salvianólico C ([MH]¯ en m/z 491.09863).
En el caso de los dos extractos más apolares (SF70, SF100) la contribución de terpenoides fue la mayor, mientras que en los extractos restantes esta clase representó aproximadamente una cuarta parte de la suma del área del pico de los compuestos identificados. Esta clase estuvo representada principalmente por los diterpenoides, que fueron la clase de compuestos no polares más variada identificada en los extractos estudiados. En su mayoría eran diterpenoides de tipo abietano, cuya fragmentación mediante ionización negativa a menudo incluía la eliminación de CO.2 (-44 Da), CO (-28 Da), H2O (-18 Da), ·CH3 (15 Da). Compuestos 59 ([MH]¯ en m/z 345.17075) y 64 ([MH]¯ en m/z 345.17100) ambos mostraron iones atribuibles a la pérdida de molécula de dióxido de carbono (m/z 301.18097) y molécula de agua (m/z 283.17038 y m/z 283.17041), y fueron identificados como rosmanol y epiisorosmanol. Compuesto 69 ([MH]¯ en m/z 329.17580) fue identificado como carnosol basándose en su patrón de fragmentación típico, comenzando con la pérdida de dióxido de carbono (m/z 285.16604)12,15 y seguido de la eliminación de un radical metilo (m/z 270.16211). El mismo patrón de fragmentación ocurrió en compuestos 80, identificado como ácido 12-metoxicarnósico ([MH]¯ en m/z 345.20721) con fragmentos de 301.21689 y 286.19385. Compuesto 78, con un ion pseudomolecular en m/z 331.19153 [MH]¯ fue identificado como ácido carnósico debido a la presencia de fragmentos correspondientes a la pérdida de dióxido de carbono y posterior pérdida de un radical isopropilo (m/z 287.20175 y 244.14687). Compuesto 70 mostró un ion precursor en [MH]¯ en m/z 343.15524, que generó fragmentos característicos m/z 315.16028 y m/z 299.160504 mediante la pérdida de etileno y dióxido de carbono, respectivamente. Esto nos permite identificar compuestos. 70 como rosmadial. También se detectaron dos triterpenoides pentacíclicos en los extractos analizados: compuesto 96 y 97, que fueron identificados tentativamente como ácido betulínico y ácido ursólico, respectivamente, con iones cuasimoleculares en ([MH]¯ en m/z 455.35340). La presencia de estos triterpenoides también se informó en S. fruticosa por Jash et al.16.
En los extractos estudiados, especialmente aquellos con alto contenido de agua (SFH2O, SF30), también se observó una proporción significativa de oligosacáridos y ácidos de azúcar en el área total del pico de los compuestos identificados. Compuestos 1, 2 y 3 se identificaron tentativamente como estaquiosa, rafinosa y sacarosa, ya que a menudo son azúcares de transporte importantes en el Salvia especies31. Compuestos 4–8 fueron clasificados como ácidos de azúcar. El patrón de fragmentación del compuesto. 6 ([MH]¯ en m/z 135.02875) era idéntica a la de yo-ácido treónico. Compuesto 8 ([MH]¯ en m/z 149.0081) fragmentos generados m/z 72.99171, 59.01249 y 87.00734 que se pueden observar en modo de ionización negativa para yo-(+)-ácido tartárico.
Otra clase importante de fitoquímicos detectados en S. fruticosa extractos fueron flavonoides. La mayoría de los compuestos identificados que pertenecen a esta clase se han asignado a las flavonas. Compuesto 24 se identificó inequívocamente como escutelarina al comparar los tiempos de retención, los espectros UV y los patrones de fragmentación MS/MS con los del estándar comercial. Compuestos 46 y 55 mostró casi los mismos iones precursores [MH]¯ en m/z 299.0563 y 299.0562. Compuesto 46 produjo los fragmentos más abundantes en m/z 284.03253 y 136.98682, igualmente compuestos 55. Estos datos se corresponden con el patrón de fragmentación de hispidulina o diosmetina. Dado que hubo una diferencia en el tiempo de retención, ambos compuestos podrían estar presentes en S. fruticosa extractos. Compuesto 49 mostró un ion precursor en [MH]¯ en m/z 285.04065 que formó iones de productos específicos en m/z 133.02834, 151.00261, 175.03903, en línea con los informados para la luteolina por Velamuri et al.17. Compuesto 52 ([MH]¯ en m/z 327.21786) fue identificada como salvigenina (pectolinarigenin-7-metil éter), ya que esta flavona se informó anteriormente en S. fruticosa. Compuesto 54 produjo el pico base [MH]¯ en m/z 269.04578. Iones precursores e iones productos en m/z 117.03332 y 151.00264 confirmaron que este compuesto es apigenina. Compuesto 56 dio el ion precursor [MH]¯ en m/z 329.0668, indicando que su fórmula molecular era C17h14oh7. Produjo iones de fragmentos prominentes en m/z 299.01981 atribuible a la pérdida de dos grupos metilo, y 271.02472, a causa de una mayor eliminación de monóxido de carbono. Por tanto, este pico se identificó como jaceosidina. Compuesto 60 se identificó como cisimaritina basada en un ion precursor [MH]¯ en m/z 313.07190 y los iones del producto de diagnóstico en m/z 298.04694 y 283.02478, que indica la pérdida de dos radicales metilo y 255.02974 por la eliminación de monóxido de carbono. Compuesto 62 ([MH]¯ en m/z 283.06137) corresponde a un derivado de apigenina considerando el fragmento en m/z 268.03772 y 117.03318. Ión de fragmento característico en m/z 240.04193 formado por la pérdida de monóxido de carbono condujo al compuesto 62 siendo identificado como genkwanin. Los patrones de fragmentación de apigenina, hispidulina, cirsimaritina y genkwanina fueron consistentes con los informados por Koutsoulas et al.12. Compuesto 50 fue el único tipo de flavonol aglicón detectado en los extractos estudiados. Con el ion precursor [MH]¯ en m/z 315.0513 y fragmento principal de MS/MS en m/z 300.02756 resultante de la pérdida del grupo metilo, este compuesto se identificó como isorhamnetina. Compuesto 30 con un ion pseudomolecular [MH]¯ en m/z 609.18329 no mostró ninguna fragmentación, pero como se informó anteriormente en S. fruticosa18,19, se identificó provisionalmente como flavanona: hesperidina. Los glucósidos flavonoides encontrados en este estudio fueron principalmente glucósidos con fragmento característico de 162 Da, glucurónidos (176 Da) y rutinósidos (308 Da). Glucósido de luteolina (compuesto 22 con [MH]¯ en m/z 447.09344) está presente en la mayoría de las publicaciones sobre la composición química de S. fruticosa extractos12,18,19,20,21. Compuesto 26 mostró un ion precursor [MH]¯ en m/z 491.0836 y fue identificado como glucurónido de isorhamnetina, informado anteriormente en S. fruticosa sólo por Gürbüz et al.22. Compuesto 27 ([MH]¯ en m/z 577.15668), identificado como apigenina-rutinósido, también fue encontrado en la salvia griega por Cvetkovikj et al.21.
La presencia de ácidos grasos también se observó en S. fruticosa extractos. Compuestos 63 y 73 fueron identificados tentativamente como dos ácidos grasos poliinsaturados. Compuesto 63 fue asignado como ácido dihidroxioctadecadienoico (C18h31oh4¯). Compuesto 73 produjo el ion precursor [MH]¯ en m/z 295.22803 y fragmentos característicos en metro/z 277.21738 ([MHH2Oh]− y 195.13837 [M-(CHO-(CH2)4-CH3)-H]¯, que indica la posición del grupo hidroxilo en el átomo de carbono 13. Así, se identificó como ácido 13-hidroxi-9,11-octadecadienoico. También en S. fruticosa extrae la presencia del glucósido del ácido tuberónico (m/z 387.16644) (compuesto 14) que es una hormona del crecimiento.
Análisis cuantitativo de los principales fitoquímicos.
Una cuantificación de los principales compuestos fenólicos en diversos extractos de S. fruticosa del peso seco del material vegetal (mg/g PS) se presenta en la Tabla 1. El contenido de ácido cafeico, escutelarina, ácido salvianólico B, ácido rosmarínico, ácido carnósico y carnosol se calculó basándose en curvas de calibración de estándares auténticos, mientras que el contenido de otros compuestos se estimó en relación con el estándar más similar disponible.
En general, el compuesto más abundante en los extractos de salvia es el ácido rosmarínico, que es un ácido fenólico y un dímero del ácido cafeico. La concentración más alta de ácido rosmarínico entre todas las muestras analizadas se encontró en SF70 (31,56 ± 1,88 mg/g DW), que es como la concentración de ácido rosmarínico en S. fruticosa recolectado en Croacia (29,10 ± 0,21 mg/g PS), informado por Mervić et al.23. Se informó un contenido aún mayor (60,73 mg/g PS) en el extracto metanólico de la variedad griega de salvia estudiada por Sarrou et al.19, pero en este estudio el uso de alcohol puro como disolvente no dio como resultado el mayor rendimiento de ácido rosmarínico. Concentración de ácido rosmarínico en la infusión (SFH2O) fue mucho menor (4,96 ± 0,65 mg/g PS) que en otros extractos, lo que no concuerda con los hallazgos de una comparación similar realizada para la variedad turca de S. fruticosa por Tekin18. También se detectó ácido cafeico en todos los extractos estudiados en concentraciones similares (0,13–0,15 mg/g PS), que fueron diez veces inferiores a las informadas por Mervić et al.23. Sin embargo, pocos ácidos salvianólicos, que pertenecen a los principales trímeros derivados del ácido cafeico en las plantas de salvia, estaban presentes en mayores cantidades. La mayor concentración de ácido salvianólico B se obtuvo en los extractos SF70 y SF30 (6,86 ± 0,93 mg/g PS y 6,52 ± 0,48 mg/g PS). El ácido salvianólico K fue el más abundante en el extracto ST30 con una concentración de 6,25 ± 1,0 mg/g PS. Según los datos presentados por Cvetkovikj et al.21, la concentración máxima de ácido salvianólico K entre varias poblaciones griegas estudiadas de S. fruticosa fue de 7,20 mg/g PS.
Los compuestos terpenoides más abundantes en S. fruticosa son el ácido carnósico y el carnosol, que pertenecen a la familia de los diterpenoides abietanos.12. El mayor contenido de ácido carnósico se observó en SF100 (14,82 ± 1,66 mg/g PS), seguido por SF70 (13,88 ± 2,52 mg/g PS), que no es estadísticamente diferente. Estos resultados están en línea con el contenido medido en extracto metanólico por Kallimanis et al.24 que fue de 12,5 ± 1,6 mg/g PS. La cantidad de carnosol en el extracto SF70 fue de 7,88 ± 1,33 mg/g PS y fue consistente con lo informado por Sarrou et al.19. El salviol, el tercer terpenoide más abundante en los extractos estudiados, es un meroterpenoide derivado del diterpenoide abietano (ferruginol) y es común en otras especies griegas de salvia, por ejemplo. S. pomifera25. Este compuesto aún no ha sido reportado en S. fruticosa; sin embargo estuvo presente en la mayoría de los extractos estudiados con el mayor contenido: 7,37 ± 0,71 mg/g PS en SF70.
El tercer grupo de bioactivos detectado en S. fruticosa Los extractos eran flavonoides. La escutelarina es uno de los flavonoides comunes que se encuentran en la salvia.26. Fue el flavonoide más abundante en los extractos estudiados con un rendimiento similar: 7,77 ± 0,48 mg/g PS, 8,92 ± 1,56 mg/g PS y 7,35 ± 0,9 mg/g PS en SFH.2Extractos O, SF30 y SF70, respectivamente. Las concentraciones de luteolina rutinósido y luteolina glucósido fueron similares en todos los extractos estudiados y oscilaron entre 1,03 y 1,98 mg/g PS, lo que no concuerda con los datos informados por Tekin et al.18, donde las concentraciones de estos compuestos en las infusiones de salvia eran dos o tres veces mayores que en los extractos de etanol.
Los ácidos fenólicos, flavonoides y terpenoides son compuestos bioactivos típicos en S. fruticosa. Como se muestra en la tabla 1, el rendimiento de la extracción se vio muy afectado por el contenido de etanol en el disolvente. La extracción con etanol 70% proporcionó el mayor rendimiento total de bioactivos, en contraste con la extracción solo con agua. La diferencia es claramente visible en el rendimiento de ácidos fenólicos y terpenoides, que en SF70 fue tres veces mayor y siete veces mayor, respectivamente. El rendimiento máximo de extracción de flavonoides se obtuvo con etanol 30%, pero fue sólo ligeramente superior al obtenido con etanol 70%. Considerando todos los grupos de bioactivos estudiados, se concluye que el etanol 70% es el mejor solvente entre los probados para la extracción de compuestos bioactivos de S. fruticosa.
Actividad antioxidante
La presencia de compuestos que exhiben actividad antioxidante en el material vegetal se ha convertido en un aspecto importante que define sus propiedades promotoras de la salud. En el caso de diversas especies de salvia, su alta actividad antioxidante está provocada principalmente por compuestos fenólicos. En los estudios presentados, la actividad antioxidante total se determinó para S. fruticosa extractos preparados con extractantes de diferente polaridad. Además, se determinó la actividad antioxidante de compuestos fenólicos seleccionados típicos de la salvia y que pertenecen a diversas clases de metabolitos secundarios, como ácidos fenólicos, flavonas y diterpenoides.
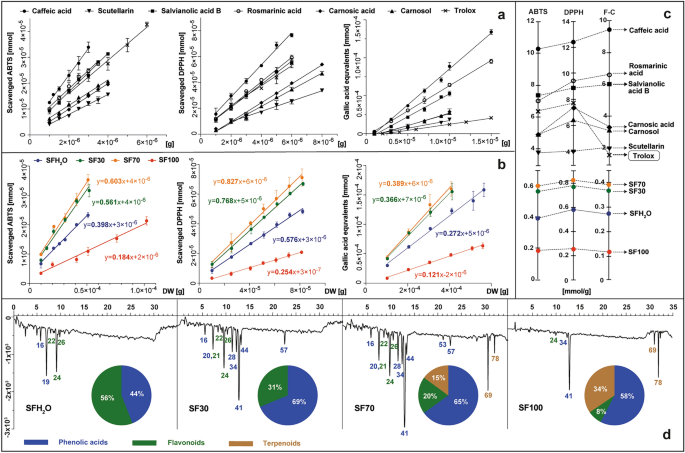
El estudio presentado comparó los resultados de las tres pruebas espectrofotométricas más populares que utilizan reactivos ABTS, DPPH y Folin-Ciocalteu (F-C). Los ensayos ABTS y DPPH se utilizan ampliamente para determinar la actividad eliminadora de radicales libres de los extractos, al igual que los compuestos puros. Para S. fruticosa En extractos, la actividad antioxidante calculada describe el número de moléculas de ABTS o DPPH reducidas por antioxidantes derivados de 1 g de material seco después de 10 minutos de reacción. Estos valores se calcularon en el rango lineal del método y se expresaron como la pendiente de la línea que describe la relación entre el número de milimoles reducidos de oxidantes y diversas cantidades de muestras analizadas, como gramos de materia seca en las mezclas de reacción (Fig. 2b).
La actividad antioxidante de los estándares (ácido cafeico, escutelarina, ácido salvianólico B, ácido rosmarínico, ácido carnósico, carnosol y trolox) y S. fruticosa extractos: SFH2O-extracto acuoso; Extracto de etanol SF30–30%; extracto de etanol SF70–70%; SF100-extracto de etanol, probado in vitro con reactivos ABTS, DPPH y F-C presentados como gráficos que muestran las curvas de dependencia del reactivo reducidas por los estándares probados (a) o extractos (b) y expresado como pendientes de las curvas iguales a los milomoles de reactivo reducidos en 1 g de muestra analizada (C) conjunto con los perfiles antioxidantes de los extractos, registrados a 734 nm después de la derivatización post-columna con ABTS, con las principales clases de antioxidantes en los gráficos circulares (d). Para conocer la identidad de los picos, consulte la tabla complementaria. T1.
El estudio también incluye el método con el reactivo de Folin-Ciocalteu. Consiste en la transferencia de electrones en un ambiente alcalino desde compuestos con grupos hidroxilo activos a complejos de ácido fosfotúngstico fosfomolíbdico. La capacidad reductora en este caso se expresó como el número de milimoles de equivalentes de ácido gálico, que formaron el complejo azul y se derivaron de 1 g de materia seca de la planta. Se utilizó el mismo enfoque para las sustancias puras seleccionadas presentes en la salvia, como: ácido cafeico, ácido carnósico, carnosol, ácido salvianólico B, escutelarina, ácido rosmarínico y adicionalmente para el antioxidante de referencia: trolox (Fig. 2a). Este método para determinar y calcular la actividad antioxidante de material vegetal y sustancias puras fue descrito previamente por Kusznierewicz et al.27 y Baranowska et al.28, respectivamente. Los valores de pendiente resultantes se trazaron en ejes separados para cada prueba realizada para estándares y muestras (Fig. 2C). Cada uno de los estándares fenólicos probados exhibió actividad antioxidante, aumentando en orden de la siguiente manera: escutelarina <carnosol <ácido carnósico <ácido salvianólico B <ácido rosmarínico <ácido cafeico. Tres de ellos (ácido salvianólico B, ácido rosmarínico y ácido cafeico) fueron más eficientes que el trolox, un compuesto comúnmente utilizado como referencia en ensayos de determinación de la actividad antioxidante. La actividad antioxidante de todos los extractos estudiados de S. fruticosa dependió de la dosis en el ensayo ABTS así como en la prueba DPPH. Por tanto, a medida que aumenta la cantidad de extracto añadido a la mezcla de reacción, también aumenta el poder reductor hacia estos radicales. La actividad antioxidante total más baja se observó para el extracto SF100, seguida por casi dos veces mayor para el SFH.2O, y casi cuatro veces mayor para SF30 y SF70. Los resultados de la prueba F-C siguieron la misma tendencia que ABTS y DPPH con una correlación de Pearson de 0,99, lo que indica que la actividad antioxidante de los extractos depende en gran medida del contenido de fenólicos, como lo demuestran Lantzouraki et al.29.
Basado en el contenido de 6 fitoquímicos seleccionados para las pruebas en los extractos (Tabla 1) y las actividades antioxidantes determinadas para ellos y para los extractos (Fig. 2a,c), podemos determinar la contribución estimada de estos compuestos a la actividad antioxidante total de los extractos individuales. En el caso de SFH2Los extractos O, SF30 y SF70, 6 compuestos seleccionados, según la prueba, cubrieron teóricamente 21–30%, 45–63% y 64–86% de la actividad antioxidante total determinada, respectivamente. Estos resultados sugieren la posible presencia de otros antioxidantes adicionales en estos extractos y/o sus efectos sinérgicos. Sólo en el caso del extracto SF100 la suma de las actividades de los 6 compuestos estándar superó la actividad total determinada de este extracto oscilando entre 20 y 49%, dependiendo de la prueba utilizada. Tal observación puede ser el resultado de posibles interacciones antagónicas entre los fitoquímicos presentes en este tipo de extracto.
Información más detallada sobre los tipos de antioxidantes presentes en los probados. S. fruticosa Los extractos se proporcionaron mediante el uso de derivatización posterior a la columna de HPLC con el reactivo ABTS. Los perfiles antioxidantes obtenidos por este método, así como la contribución de diferentes clases de antioxidantes en la actividad antioxidante total, se muestran en la Fig. 2d. Además de los 6 antioxidantes estándar probados anteriormente, el S. fruticosa Los extractos también contenían otros antioxidantes como ácido przewalskínico A, salviaflasida, luteolina rutinósido, glucósido de luteolina, glucurónido de isorhamnetina, cumaroil cafeoilglucósido, ácido salvianólico K y ácido salvianólico F. Perfiles caracterizados por el mayor número y tamaño de picos negativos que indican la reducción y decoloración de Se observaron radicales ABTS para los extractos SF70 y SF30. A pesar de la similitud de los perfiles antioxidantes de estas dos muestras, la intensidad de las señales comunes fue mayor para el SF70 y también se observó actividad adicional procedente de los diterpenoides. Sólo en los perfiles de los extractos SF70 y SF100 se observaron picos negativos provenientes de los diterpenoides, con su participación en la actividad antirradical total en 15 y 34%, respectivamente. El principal antioxidante en todos los extractos que contenían etanol fue el ácido rosmarínico, el ácido fenólico más abundante y uno de los antioxidantes más fuertes entre los estándares estudiados. El mismo resultado también se informó para S. officinalis y S. hispanica extractos30,31.
En extracto acuoso (SFH2O) la actividad antioxidante se originó principalmente a partir de dos compuestos: el ácido przewalskinico A y la escutelarina, ya que la extracción con ácido rosmarínico solo con agua fue menos efectiva.
Actividad inhibidora de la xantina oxidasa.
La enzima xantina oxidasa (XO) cataliza la oxidación de hipoxantina y xantina a ácido úrico, cuyo exceso en la sangre provoca el desarrollo de gota. Durante la reoxidación de XO, el oxígeno molecular actúa como aceptor de electrones, produciendo un radical superóxido y peróxido de hidrógeno. En consecuencia, la XO se considera una importante fuente biológica de radicales superóxido que, junto con otras especies reactivas de oxígeno, contribuyen al estrés oxidativo del organismo y participan en numerosos procesos patológicos como la inflamación, la aterosclerosis, el cáncer, el envejecimiento, etc.32. Un enfoque terapéutico reciente para el tratamiento de la hiperuricemia es inhibir la enzima XO. Se han desarrollado varios fármacos que contienen inhibidores de la XO (alopurinol, febuxostat), cuyo uso lamentablemente se asocia con determinados efectos secundarios. Por este motivo, existe una búsqueda constante de inhibidores naturales de la XO que puedan suponer una alternativa a estos compuestos sintéticos. Hay algunos informes en la literatura sobre la capacidad de varias especies de Salvia (S. plebeia, S. miltiorrhiza, S. verbenaca) para inhibir la XO33,34,35, por lo tanto, la posible ocurrencia de esta actividad también fue probada en los estudios estudiados. S. fruticosa extractos. Además, también se determinó la actividad inhibidora de XO en compuestos fenólicos seleccionados típicos de la salvia, tales como: ácido cafeico, ácido carnósico, carnosol, ácido salvianólico B, escutelarina, ácido rosmarínico y adicionalmente, como referencia, el inhibidor de XO alopurinol.
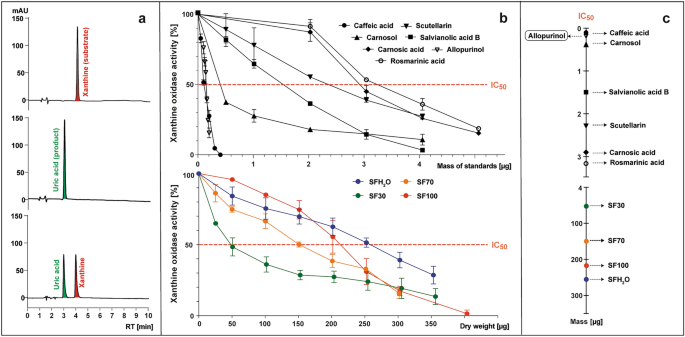
La transformación de xantina (sustrato) en ácido úrico (producto) por XO con o sin la presencia de muestras analizadas se monitoreó con el uso de HPLC-PAD a 285 nm (Fig. 3a). La actividad enzimática se calculó como el porcentaje del área del pico de ácido úrico formado en presencia de la muestra analizada en comparación con el control sin la adición de la muestra (Fig. 3b). La inhibición de la enzima XO se expresó como IC.50 valor, es decir, la masa de estándar o peso seco de la muestra (μg) capaz de reducir la actividad enzimática a 50% (Fig. 3antes de Cristo).
Los ejemplos de cromatogramas de HPLC a 285 nm de mezclas posteriores a la reacción que contienen (desde arriba): xantina; xantina y xantina oxidasa (XO); xantina, XO e inhibidor (a), que sirvieron de base para la preparación de los gráficos que representan las curvas de actividad XO en presencia de estándares probados (ácido cafeico, escutelarina, ácido salvianólico B, ácido rosmarínico, ácido carnósico, carnosol y alopurinol) o S. fruticosa extractos (SFH2O-extracto acuoso; Extracto de etanol SF30–30%; extracto de etanol SF70–70%; SF100 – extracto de etanol) (b), que se utilizaron para determinar el parámetro IC50, es decir, los microgramos de muestra analizada necesarios para reducir la actividad XO a 50% (C).
Se utilizó como referencia el conocido inhibidor de XO alopurinol, con una IC50 valor de 0,15 µg (5,5 µM). Todos los estándares estudiados mostraron actividad inhibidora de XO con un IC.50 que van desde 0,1 a 3,15 μg (2,8 a 43,8 μM). La actividad inhibidora de XO aumentó en el siguiente orden: ácido rosmarínico <ácido carnósico <escutelarina <ácido salvianólico B <carnosol <ácido cafeico. El ácido cafeico mostró el IC más bajo.50 valor (0,1 μg; 2,8 μM), que indica la actividad inhibidora de XO más fuerte entre los compuestos probados. Fue incluso más potente que el alopurinol, lo que no concuerda con los datos presentados por Wan et al.36 y Flemmig et al.37, donde el CI50 de ácido cafeico fue casi 8 o 2 veces menor que la de alopurinol, respectivamente. Estas diferencias pueden deberse al origen de la XO seleccionada para las pruebas. En los estudios citados se utilizó una oxidasa procedente de leche bovina, mientras que para este estudio se seleccionó una oxidasa microbiana. En este estudio, el ácido rosmarínico tuvo el nivel más bajo para inhibir la XO (3,2 μg; 43,8 μM), pero Ghallab et al.38 informaron que la combinación sinérgica de alopurinol y ácido rosmarínico puede reducir la dosis necesaria de drogas sintéticas. XO fue inhibida por todos los estudiados S. fruticosa extractos, aunque más de 1000 veces menos eficaz que el alopurinol, en línea con los datos informados para otros Salvia especies. La escutelarina y otras flavonas se han descrito previamente como potentes inhibidores de la XO.39. A pesar de que sólo hubo una ligera diferencia en el contenido de flavonoides totales entre el extracto SF30 y SF70, y que el contenido de otros compuestos antiinflamatorios fue más favorable para el extracto SF70, el SF30 tuvo la mayor capacidad para inhibir la actividad XO. El CI50 El valor de SF30 fue de 50 μg y, según este parámetro, se determinó la actividad antiinflamatoria potencial de SF70, SF100 y SFH.2Se determinó que los extractos de O eran 3, 4 y 5 veces más débiles, respectivamente.